REGRA DO OCTETO
"Um grande número de átomos adquire estabilidade
quando alcança no nível mais externo das suas eletrosferas
um arranjo eletrônico idêntico ao de um GÁS NOBRE."
LIGAÇÃO IÔNICA
ESTA LIGAÇÃO APARECE SEMPRE QUE:
↓ ↓
Átomos perdem Átomos ganham
elétrons(metais) elétrons (não-metais)
↓ ↓
1 a 3 ë de Valência 5 a 7 ë de Valência
↓ ↓
CÁTION ÂNION
OBSERVAÇÃO:
A ligação iônica se caracteriza por possuir diferença de eletronegatividade dos elementos participantes superior a 1.7.

PROPRIEDADES:
- NÃO FORMA MOLÉCULAS E SIM ASSOCIAÇÕES COMPACTAS DE ÍONS, ISTO É,
SÃO SÓLIDOS CRISTALINOS (ÍON-FÓRMULA).
- APRESENTAM ELEVADO PONTO DE FUSÃO E EBULIÇÃO
- OS CRISTAIS SÃO DUROS E QUEBRADIÇOS
- NO ESTADO SÓLIDO NÃO CONDUZEM ELETRICIDADE,
MAS EM SOLUÇÃO AQUOSA OU FUNDIDOS CONDUZEM ELETRICIDADE PORQUE OS ÍONS SÃO LIBERADOS.
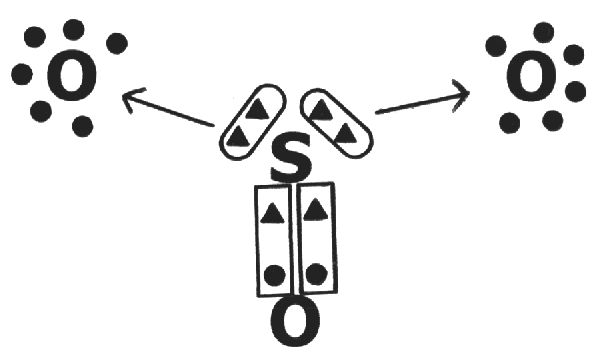
LIGAÇÃO COVALENTE
Diferentemente da ligação iônica a ligação covalente ocorre na forma de compartilhamento de elétrons.
COMPARTILHAMENTO DE
ELÉTRONS
ganha elétrons ganha elétrons
NÃO-METAL NÃO-METAL
↓ ↓
HIDROGÊNIO NÃO-METAL
PROPRIEDADES
- FORMAM MOLÉCULAS, UNIDADES DISCRETAS DE MATÉRIA, SEM CARGA ELÉTRICA.
- SÃO OS MAIS NUMEROSOS, POIS ABRANGEM QUASE A TOTALIDADE DOS COMPOSTOS ORGÂNICOS.
- TEM PONTO DE FUSÃO E DE EBULIÇÃP BAIXO, PREDOMINANDO O ESTADO LÍQUIDO.
- SOLUBILIDADE EM ÁGUA:
- APLOARES INSOLÚVEIS
- POLARES- SOLÚVEIS
- NÃO CONDUZEM A CORRENTE ELÉTRICA QUANDO PUROS. APENAS OS COMPOSTOS DISSOLVIDOS EM ÁGUA CONDUZEM A CORRENTE ELÉTRICA.
AS LIGAÇÕES COVALENTES E AS FAMÍLIAS

* LIGAÇÃO COVLENTE POLAR - É a ligação estabelecida em geral entre dois não-metais diferentes. Há diferença de eletronegatividade.

* LIGAÇÃO COVALENTE APOLAR - É a ligação estabelecida em geral entre dois átomos de um mesmo não-metl. Não há diferença de eletronegativdade.

*LIGAÇÃO COVALENTE DATIVA - É um caso particular de ligações covalentes em que o par de elétrons da ligação é contribuição apenas de um dos átomos que participam do compartilhamento.
POR RAPHAELA SALES
ESTUDANTE DE ENGENHARIA QUÍMICA








