EXERCÍCIOS RESOLVIDOS
1. Qual o pH de uma solução cuja concentração hidrogeniônica ([H+] é 10-8 ?
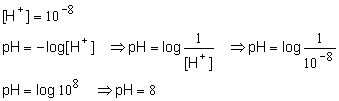
2. Calcular o pH de um meio cuja concentração hidrogeniônica é 0,01 mol/L.

3. Qual é o pH de uma solução cuja concentração hidroxiliônica é de 0,1 mol/L?

4. Calcular o pH de uma solução de ácido clorídrico – HCl – 0,1M

5. Determine o pH de uma solução 0,005M de ácido sulfúrico?
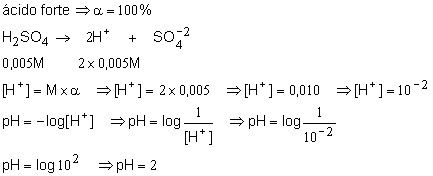
6.Uma solução apresenta concentração hidrogeniônica igual a 10-11 mol/L. Qual é o seu pOH?

7. Foi preparada uma solução 0,04M de ácido clorídrico (HCl). Descobrir o seu pOH.
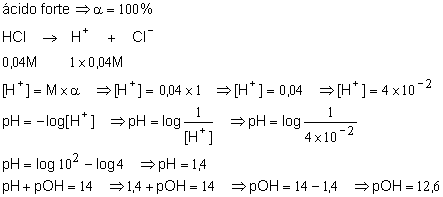
8. Foi preparada uma solução 0,8M de hidróxido de sódio (NaOH). Qual o seu pH?

9. Qual o pH de uma solução 0,2M de ácido acético (HAc), sabendo que, nessa diluição, o grau de ionização é igual a 0,5%?

10. Em uma solução aquosa 0,1M, o ácido acético (HAc) está 1% ionizado. Calcular a concentração hidrogeniônica e o pH da solução.

11. Qual é a concentração de íons H+ de uma cerveja cujo pH é 4,5
12. Em uma solução de pH=4, um mol de H+ está contido em quantos litros de solução?

13. O pH de uma solução de ácido clorídrico é 2. Adicionando-se um litro de água a um litro de solução de ácido clorídrico , qual o novo pH?

14. Dissolveu-se 5x10-4 mol do eletrólito forte Ca(OH)2 em água para obterem-se 100 mL de uma solução saturada desse hidróxido. Qual será o pH dessa solução?

15. A 3g de ácido acético (HAc – Massa molar 60g/mol) foi adicionada água suficiente para completar 500 mL de solução. Sabendo que nessa concentração o grau de ionização do ácido é de 1%, calcule, para essa solução:
a)concentração hidrogeniônica – [H+]
b)potencial hidrogeniônico - pH
c)concentração hidroxiliônica – [OH-]
d)potencial hidroxiliônico - pOH

16. Temos uma solução 0,05M de hidróxido de amônio (NH4OH). Calcular o pH e o pOH dessa solução, sabendo que a constante de ionização da base é 2x10-5.

AGORA É SUA VEZ
01. O pH de uma solução é 6. Se reduzirmos o valor do pH da mesma solução para 2, a concentração de íons hidrogênio será:
a) 10.000 vezes maior do que a inicial;
b) 1.000 vezes maior do que a inicial;
c) 1.000 vezes menor do que a inicial;
d) 4 vezes menor do que a inicial;
e) 3 vezes maior do que a inicial.
02. (SANTA CASA) Considerando os valores da constante de ionização da água em função da temperatura:
| Temperatura (K) | Kw |
| 298 | 1 x 10-14 |
| 323 | 5,3 x 10-14 |
Podemos afirmar que na água pura:
a) [H+] = [OH-] a qualquer temperatura
b) [OH-] > 1 x 10-7 a 298 K
c) [H+] < 1 x 10-7 a 298 K
d) [OH-] < 1 x 10-7 a 323 K
e) [H+] < 1 x 10-7 a 323 K
03. (SANTA CASA) A 45°C o produto iônico da água é igual a 4 x 10-14. A essa temperatura o valor de [H+] de uma solução aquosa neutra é:
a) 6 x 10-7
b) 2 x 10-7
c) 4 x 10-7
d) 2 x 10-14
e) 4 x 10-14
04. (PUC) O produto iônico da água aumenta com a temperatura e a 100°C vale aproximadamente 10-13. Nesta temperatura, uma solução que apresente pH = 7:
a) é forçosamente básica.
b) é forçosamente ácida.
c) é forçosamente neutra.
d) tem um caráter que depende da natureza do soluto.
e) tem um caráter que depende da volatilidade do soluto.
05. (PUC) Para conseguirmos aumentar o pH de uma solução aquosa, devemos nela borbulhar o gás:
a) clorídrico
b) amônia
c) cianídrico
d) carbônico
e) hidrogênio
06. (COMBIMED) Tem-se uma solução a pH = 7,0 e pretende-se acidificá-la de modo que o pH fique em torno de 6,0. Pode-se conseguir isso borbulhando na solução:
a) NH3
b) H2
c) CH4
d) CO2
e) N2
07. (POUSO ALEGRE) O pH de uma solução que contém 8,5 x 10-3g por litro de OH- é:
Dado: log 5 = 0,7 O = 16 H = 1
a) 10,7
b) 10
c) 9,3
d) 4,7
e) 3,3
08. (UnB) Para evitar que os meninos continuem urinando nas piscinas que devem estar em pH neutro, vem sendo usado um indicador na água, que passa de incolor para vermelho vivo, no momento e que a acidez aumenta pela adição de ácido úrico. Considerando-se o volume de 4,5 litros de água de uma piscina atingindo por meio litro de urina contendo H+ na concentração 10-3 molar, a variação de pH será aproximadamente:
a) 1 unidade
b) 2 unidades
c) 3 unidades
d) 4 unidades
e) n.d.a.
09. (FUVEST) Calcular a concentração hidroxiliônica e o pH de uma solução aquosa 0,01 molar de hidróxido de sódio, a 25°C.
[H+] [HO-] = 10-14 (a 25°C)
10. (USP) Juntando-se cloreto de sódio a uma solução diluída de ácido clorídrico, o pH da solução:
a) diminui.
b) aumenta.
c) permanece praticamente constante.
d) diminui, passa por um mínimo e volta ao valor original.
e) aumenta, passa por um máximo e volta ao valor original.
Resolução:
| 01. A | 02. A |
03. B | 04. A |
| 05. B |
06. D |
07. A | 08. C |
09. [OH-] = 10-2 íons . g / l
pH = 12
10. C







