BREVE RESUMO HISTÓRICO SOBRE A TEORIA ATÔMICA
Dalton 1808: disse que o átomo era uma esfera rígida e indivisível; e que substâncias
formadas por elementos em proporções definidas. Modelo da Bola de Bilhar
Thompson, fim do séc XIX: esfera maciça onde, apresenta cargas negativas e positivas.
Modelo do Pudim de Passas
Milikan: Descobriu a carga e a massa de um elétron.
Rutherford 1911: núcleo positivo denso e em seu redor possui eletrosfera com seus eletrons.
Segundo ele os átomos não se encostavam numa na outra. sua falha foi não explicar o fato do núcleo
contituintes de particulas positivas na se repelem.
Modelo do Sistema Planetário - SISTEMA SOLAR.
Chadwich 1932: descobriu a existência do neutron
Bohr: Completou o modelo de Rutherford; falou que todos os elétrons são iguais,
mas com energia diferentes demonstrando os orbitais, região do átomo que é mais
provável encontrar o elétron; e quando o elétron gira em torno dele ele não perde e nem ganha energia.
Conceitos fundamentais
Número atómico :
Também representado pela letra (Z): número de prótons existente no núcleo de um
átomo.
Em um átomo, onde sua carga é zero o número de prótons é igual ao número de elétrons.
Número de massa: também representado pela letra (A):
é a soma do número de prótons e nêutrons existentes num átomo.
Isótopos: São átomos com o mesmo número de protons.
Isóbaros: São átomos com o mesmo número de massas.
Isótonos: São átomos com o mesmo número de neutrons.
Nos sabemos que a eletrosfera é dividida em 7 camadas nos quais representamos por letra:
K,L,M,N,O,P,Q.
Onde também são representados por números que chamamos de números quânticos principal(n)
respectivamente:1,2,3,4,5,6,7.
Cada camada suporta um número máximo de elétrons e orbitais.
Esses sub nível (l) também é conhecido como número quântico secundário ou azimutal expresso
pela letra s, p, d, f como as camadas, eles também são representados por números respectivamente
0,1,2,3 onde o orbital s suporta dois, o p suporta 6, o d suporta 10 e o f, 14 elétrons
Podemos representar isso graficamente:
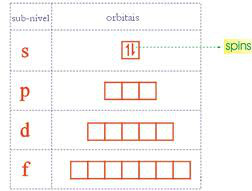
como na imagem cada quadrado é um orbital cada orbital cabe 2 eletrons e para representar
o orbital usa-se o número quântico magnético(m), no caso do s o primeiro quadrado
é o número 0 no p o primeiro é -1 o segundo é 0 e o
terceiro -1 no d é -2,-1,0,1,2 no f é -3,-2,-1,0,1,2,3 (da esquerda para a direita)
Diagrama de Pauling:

Espero que possa ajudar e até o próximo resumo de química.
Escrito por Raphaela Sales
Estudante de Engenharia Química.








