<img src="https://img.comunidades.net/dea/dealunoparaaluno/images.jpg" border="0">
AQUI ESTÃO ALGUNS ERXERCÍCIOS SOBRE AS TRÊS POSTAGENS ANTERIORES.
01. (ITAJUBÁ) Rutherford, em seu clássico experimento, bombardeou uma delgada lâmina com partículas alfa. Nessa experiência, ele demonstrou que:
a) todos os átomos dos elementos possuem elétrons;
b) o volume nuclear é muito pequeno em relação ao volume do átomo;
c) os elétrons tem carga elétrica negativa;
d) os elétrons giram em órbitas elípticas ao redor do núcleo;
e) a matéria é compacta e impenetrável.
02. (METODISTA) Os raios catódicos são constituídos por:
a) elétrons
b) prótons
c) cátions
d) ânions
e) n.d.a.
03. (OSEC) Algumas correções feitas por Böhr ao átomo de Rutherford referem-se:
a) ao eletromagnetismo
b) à quantização de energia
c) à teoria da relatividade
d) ao núcleo do átomo
e) n.d.a.
04. Deve-se a Böhr a idéia de:
a) níveis de energia
b) núcleo atômico
c) átomo semelhante ao sistema planetário
d) número atômico
e) isótopos
05. No esquema abaixo, um elétron saltando de K para L deve: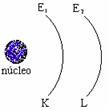
a) absorver uma energia E1;
b) absorver uma energia E2
c) absorver uma energia (E1 + E2);
d) absorver uma energia (E2 – E1);
e) devolver uma energia (E2 – E1).
06. Com relação ao teste anterior, quando o elétron retorna de L para K, deve:
a) perder a massa e ganhar energia;
b) emitir energia na forma e ondas eletromagnéticas;
c) devolver energia (E2 + E1);
d) devolver energia (E2 – E1);
e) devolver energia E2.
Analise o seguinte texto:
“Todos os tipos de átomos, quando excitados, poderão emitir ondas eletromagnéticas correspondentes aos espectros visíveis, ultravioleta etc. Essas emissões podem ser analisadas pela Espectroscopia. Cada emissão proveniente de um átomo pode ser decomposta e fotografada, produzindo-se um conjunto de raias ou bandas. Cada tipo de átomo apresenta um conjunto de raias ou bandas. Cada tipo de átomo apresenta um conjunto característico de raias, ou seja, um espectro característico.”
Os testes n.º 07 e 08 deverão ser respondidos em função do texto anterior.
07. O texto permite estabelecer que:
a) átomos emitem energia mesmo quando não excitados;
b) é possível identificar os elementos constituintes do Sol;
c) o espectro não um conjunto de raias característico para cada átomo;
d) os átomos, quando ativados, nunca emitem luz;
e) os átomos, quando ativados, nunca emitem ondas ultravioleta.
08. O texto anterior explica:
a) por que o sódio emite uma luz amarela característica quando ativado;
b) por que 1 mol de gás nas CNPT ocupa um volume de 22,4l;
c) por que 1 mol de H2O apresenta 6 . 1023 moléculas;
d) como podemos analisar a composição da Lua através da luz que ela reflete do Sol;
e) como determinar a massa de um átomo.
09. Analise o texto:
A energia de um subnível pode ser dada pela soma (n + l). Ocorrendo empates, terá maior energia o elétron com maior valor de n.”
Portanto:
a) O subnível 4s tem maior energia que o subnível 3d.
b) O subnível 4p tem menor energia que 4s.
c) Para um dado nível sempre o subnível s apresentará maior energia que os subníveis p, d ou f.
d) O subnível 6d tem maior energia que 7s.
e) Poderão existir dois subníveis com a mesma energia real.
10. No esquema abaixo encontramos duas distribuições eletrônicas de um mesmo átomo neutro.
1s2 2s2 1s2 2s1 2p1
A B
a) A é a configuração ativada.
b) B é a configuração normal.
c) A passagem de A para B liberta energia na forma de ondas eletromagnéticas.
d) A é um gás nobre.
e) A passagem de A para B absorve energia.
Resolução:
| 01. B | 02. A | 03. B | 04. A |
| 05. D | 06. B | 07. B | 08. A |
| 09. D | 10. E |
1- Três líquidos (água, benzeno e clorofórmio) foram colocados numa proveta, originando o seguinte aspecto:

A seguir temos uma tabela com as densidades de cada líquido. Baseando-se nessas informações e em seus conhecimentos sobre densidade, relacione as substâncias A, B e C com as mencionadas na tabela. Justifique sua resposta.

2- Na tabela abaixo temos as densidades de alguns materiais sólidos. Se eles forem adicionados à água líquida e pura, à temperatura ambiente, qual deles flutuará?
Pau-brasil .............................. 0,4 g/cm3
Alumínio ................................ 2,70 g/cm3
Diamante .................................3,5 g/cm3
Chumbo...................................11,3 g/cm3
Carvão ..................................... 0,5 g/cm3
Mercúrio .................................13,6 g/cm3
Água ......................................... 1,0 g/cm3
3- Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?
a) 2g/L
b) 4g/L
c) 6 g/L
d) 8 g/L
e) 10 g/L
4- Um técnico de laboratório preparou uma solução aquosa de ácido sulfúrico (H2SO4) misturando 33 g desse ácido em 200 mL de água, com extremo cuidado, lentamente, sob agitação e em uma capela com exaustor. Ao final, a solução ficou com um volume de 220 mL. A concentração em g/L dessa solução é:
a) 0,15
b) 0,165
c) 66
d) 15
e) 150
5- (Fuvest-SP) A concentração de íons fluoreto em uma água de uso doméstico é de 5,0 · 10–5 mol/litro. Se uma pessoa tomar 3,0 litros dessa água por dia, ao fim de um dia, a massa de fluoreto, em miligramas, que essa pessoa ingeriu é igual a: (massa molar do fluoreto: 19,0 g/mol)
a) 0,9.
b) 1,3.
c) 2,8.
d) 5,7.
e) 15.
6- (Vunesp-SP) O limite máximo de concentração de íon Hg2+ admitido para seres humanos é de 6 miligramas por litro de sangue. O limite máximo, expresso em mol de Hg2+ por litro de sangue, é igual a: (massa molar de Hg = 200 g/mol)
a) 3 · 10–5.
b) 6 · 10–3.
c) 3 · 10–2.
d) 6.
e) 200.
7- Uma solução de 368 g de glicerina (C3H8O3) em 1600 g de água apresenta densidade de 1,044 g/cm3. Calcule a concentração em mol/L dessa solução. Dados: massas atômicas: H = 1; C = 12; O =16.







